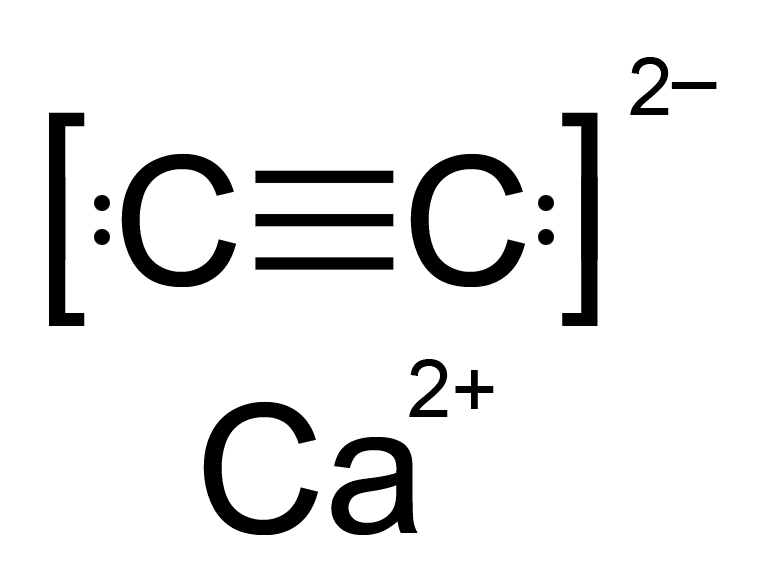탄화 칼슘
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탄화 칼슘은 생석회와 탄소를 고온에서 반응시켜 제조되는 화합물이다. 순수한 탄화 칼슘은 무색 고체이며, 물과 반응하여 아세틸렌 기체를 생성한다. 탄화 칼슘은 아세틸렌 생산, 제철 산업에서의 탈황, 칼슘시아나마이드 합성 등에 사용되며, 과거에는 카바이드 램프의 연료로도 사용되었다. 환경 및 안전 문제와 관련하여, 탄화 칼슘과 물의 반응에서 생성되는 아세틸렌은 가연성이 높고, 불순물에 의해 유해한 가스가 발생할 수 있다.
더 읽어볼만한 페이지
- 건조제 - 몬모릴로나이트
몬모릴로나이트는 층상구조 점토광물로 이온 교환 능력과 높은 수분 흡수력을 가지며, 토목공학, 유화 작용, 티크소트로피 등의 특징을 보이고, 알칼리성 토양 및 열수 변질 작용으로 생성되어 다양한 산업 분야와 환경 정화에 활용되며 인체 건강 및 환경 영향에 대한 연구가 진행 중이다. - 건조제 - 황산 칼슘
황산 칼슘은 칼슘의 황산염으로 수화 정도에 따라 다양한 결정 구조를 가지며 건설, 식품, 치의학 등 여러 산업 분야에서 활용되는 광물이다. - 칼슘 화합물 - 몬모릴로나이트
몬모릴로나이트는 층상구조 점토광물로 이온 교환 능력과 높은 수분 흡수력을 가지며, 토목공학, 유화 작용, 티크소트로피 등의 특징을 보이고, 알칼리성 토양 및 열수 변질 작용으로 생성되어 다양한 산업 분야와 환경 정화에 활용되며 인체 건강 및 환경 영향에 대한 연구가 진행 중이다. - 칼슘 화합물 - BSCCO
비스무트계 고온 초전도체(BSCCO)는 비스무트, 스트론튬, 칼슘, 구리, 산소로 구성된 물질로, 다양한 조성비를 가지며 110 K 이상의 높은 임계온도를 나타내는 상을 형성하고, 초전도선 제작에 사용되는 등 여러 분야에서 응용 가능성을 보인다.
2. 제조법
생석회(산화 칼슘)와 탄소의 혼합물을 높은 온도에서 가열하면 탄화 칼슘이 생성된다. 반응식은 다음과 같다.
:CaO + 3C → CaC2 + CO
산업적으로 탄화 칼슘은 약 2200°C의 전기 아크로에 석회석과 코크스를 함께 넣고 가열하여 생산한다.[2] 이 반응은 몰당 110kcal의 에너지를 필요로 하는 흡열 반응이며,[5] 일산화 탄소를 제거하기 위해 고온이 필요하다. 이 방법은 1892년 발명된 이후로 변화가 없다.
일반적인 연료 연소 방식으로는 이 반응에 필요한 고온을 달성하기 어렵기 때문에, 흑연 전극을 사용하는 전기 아크로에서 반응을 진행한다. 이렇게 생산된 탄화물 제품에는 일반적으로 약 80% (중량 기준)의 탄화 칼슘이 포함되어 있다. 탄화 칼슘은 수 mm에서 최대 50mm까지 다양한 크기의 덩어리로 분쇄되며, 불순물은 미세한 입자에 집중되어 있다. 제품의 CaC2 함량은 가수분해 시 생성되는 아세틸렌의 양을 측정하여 분석한다. 예를 들어, 더 큰 입자의 함량에 대한 영국과 독일 표준은 각각 295 L/kg과 300 L/kg이다(101 kPa 압력 및 20°C 온도). 탄화물에 존재하는 불순물에는 인화 칼슘이 있으며, 이는 가수분해될 때 포스핀을 생성한다.
이 반응은 화학 분야의 산업 혁명에서 중요한 부분을 차지했으며, 20세기 초 이전에 나이아가라 폭포에서 생산된 값싼 대량의 수력 덕분에 미국에서 가능해졌다.[7] 1892년 T. L. 윌슨과 H. 무아상에 의해 독립적으로 발견되었다.[8][9][10] 야이체 (보스니아 헤르체고비나)에서는 오스트리아의 산업가 요제프 크란츠와 그의 회사 ''"Bosnische-Elektrizitäts AG"''(후에 ''"Elektro-Bosna"''가 됨)가 1899년 당시 유럽에서 가장 큰 탄화칼슘 생산 화학 공장을 열었다. 8MW의 설치 용량을 가진 플리바 강에 수력 발전소가 건설되어 공장에 전기를 공급했는데, 이는 동남유럽 최초의 발전소였으며 1899년 3월 24일 가동을 시작했다.[11]
2. 1. 한국의 탄화칼슘 제조 역사
1902년 후지야마 조이치 기술사장이 센다이시 교외의 미이자와 발전소에서 일본 최초로 탄화칼슘 제조에 성공했다. 후지야마는 평소 전기에너지 이용에 관심이 많았고, 미이자와 발전소에서 발전되는 전력을 이용하여 탄화칼슘을 제조한 후, 같은 해 4월에 "미이자와 카바이드 제조소"가 설립되었다.[28] 1907년(메이지 40년)에 노구치 준과 함께 일본 카바이드 상회를 설립했다.3. 성질
물과 반응하여 아세틸렌 기체를 생성한다.[2]
:CaC2 + 2H2O → Ca(OH)2 + C2H2
순수한 탄화칼슘은 무색의 고체이다. 상온에서 일반적인 결정 구조는 C₂²⁻ 단위가 평행하게 배열된 찌그러진 암염 구조이다. 상온에서 정방정계 구조와 두 가지의 다른 단사정계 구조를 포함한 세 가지 다형체가 나타난다.[1]
4. 용도
탄화칼슘은 다양한 용도로 사용된다. 1862년 프리드리히 뵐러가 발견한 탄화칼슘과 물의 반응은 아세틸렌을 생성하는데, 1그램의 CaC2에서 370밀리리터의 아세틸렌이 생성된다.[2]
:
이 반응은 아세틸렌 램프와 같은 전통적인 조명 기구에 사용되며, 용해 아세틸렌의 공업적 제조에도 응용되어 현대 산업에서 탄화칼슘의 주요 용도 중 하나이다.
탄화칼슘은 제철업에서 산소나 황과 같은 불순물을 제거하는 데 사용되며, 汲み取り式(くみとりしき) 화장실의 산화제거제로도 사용된다.
네덜란드와 벨기에의 전통 놀이인 "Carbidschieten"(카바이드 쏘기)이나, 장난감 대포(빅뱅 캐논 등)에도 사용된다. 인화칼슘과 함께 자연발생적인 조명탄에도 사용된다.
또한, 고온(약 1100°C)에서 질소와 반응시켜 비료로 사용되는 칼슘시아나마이드를 합성할 수 있다. 이는 질소 분자의 강한 삼중 결합을 화학적으로 절단하는 몇 안 되는 방법 중 하나이다.[16]
:
4. 1. 아세틸렌 생산
물과 반응하여 아세틸렌 기체를 생성한다.[2]:CaC2 + 2H2O → Ca(OH)2 + C2H2
이 반응은 아세틸렌의 산업적 제조의 기초가 되었으며, 탄화칼슘의 주요 산업적 용도이다. 1그램의 CaC2에서 370ml의 아세틸렌이 생성된다.
오늘날 아세틸렌은 주로 메탄의 부분 연소를 통해 제조되거나 탄화수소의 분해 과정에서 에틸렌 생성물의 부산물로 얻어진다. 매년 약 40만 톤이 이러한 방식으로 생산된다(아세틸렌 제조 참조).
중국에서는 탄화칼슘에서 얻은 아세틸렌이 특히 폴리염화비닐 생산을 위한 화학 산업의 원료로 남아 있다.[12] 현지에서 생산된 아세틸렌은 수입 석유를 사용하는 것보다 경제적이다.[12] 2005년 중국의 탄화칼슘 생산량은 894만ton이었고, 생산 능력은 1700만ton이었다.[13]
미국, 유럽 및 일본에서는 탄화칼슘 소비량이 일반적으로 감소하고 있다.[14] 1990년대 미국의 생산량은 연간 약 21409.566만kg이었다.[15]
4. 2. 제철 산업
탄화칼슘은 제철 산업에서 다음과 같이 사용된다.[2]- 철의 탈황(용철, 주철 및 강)에 사용된다.
- 경제성에 따라 고철 비율을 액체 철로 늘리기 위한 제강 연료로 사용된다.
- 용탕 처리 시설에서 강력한 탈산제로 사용된다.
제철업에서 탄화칼슘은 제련 과정에서 산소나 황과 같은 불순물을 제거하는 단계에서 첨가된다.
4. 3. 화학 산업
프리드리히 뵐러가 발견한 탄화칼슘과 물의 반응은 아세틸렌과 수산화칼슘을 생성한다.[2]:CaC2(s) + 2H2O(l) → C2H2(g) + Ca(OH)2(aq)
이 반응은 아세틸렌의 산업적 제조의 기초가 되었으며, 탄화칼슘의 주요 산업적 용도이다. 1그램의 CaC2에서 370밀리리터의 아세틸렌이 생성된다.
오늘날 아세틸렌은 주로 메탄의 부분 연소를 통해 제조되거나 탄화수소의 분해 과정에서 에틸렌 생성물의 부산물로 얻어진다. 매년 약 40만 톤이 이러한 방식으로 생산된다(아세틸렌 제조 참조).
중국에서는 탄화칼슘에서 얻은 아세틸렌이 폴리염화비닐 생산을 위한 화학 산업의 원료로 남아 있다.[12] 현지에서 생산된 아세틸렌은 수입 석유를 사용하는 것보다 경제적이다.[12] 2005년 중국의 탄화칼슘 생산량은 894만 톤이었고, 생산 능력은 1700만 톤이었다.[13]
미국, 유럽 및 일본에서는 탄화칼슘 소비량이 일반적으로 감소하고 있다.[14] 1990년대 미국의 생산량은 연간 약 21409.566만kg이었다.[15]
탄화칼슘은 고온에서 질소와 반응하여 시아나마이드칼슘을 생성한다.[16]
:CaC2 + N2 → CaCN2 + C
일반적으로 니트로라임으로 알려진 시아나마이드칼슘은 비료로 사용되며, 시아나마이드(H2NCN)로 가수분해된다.[2]
4. 4. 기타 용도
카바이드 램프는 탄화 칼슘을 이용해 아세틸렌 가스를 발생시키고, 이를 연소시켜 빛을 내는 장치이다. 양초보다 안정적이고 밝은 빛을 제공했지만, 석탄 광산에서는 메탄 가스와 반응하여 폭발 위험이 있어 안전 램프로 대체되었다. 하지만 슬레이트, 구리, 주석 광산에서는 여전히 사용되었으며, 현재 대부분의 광산용 램프는 전기 헤드램프로 대체되었다.[17] 일부 저개발 국가 광산이나 동굴 탐험가들이 사용하기도 하지만, LED 조명으로 대체되는 추세이다.[17] 초기 자동차, 오토바이, 자전거의 헤드램프로도 사용되었으나, 현재는 전기 램프로 완전히 대체되었다.[18]
탄화 칼슘은 에틸렌 가스와 유사하게 과일 숙성 촉진제로 사용될 수 있다.[19] 하지만 불순물 때문에 포스핀과 아르신이 생성될 수 있어 일부 국가에서는 사용이 금지되어 있다.[20][21]
빅뱅 캐논 같은 장난감 대포나 대나무 대포에도 사용되며, 네덜란드에서는 새해 전후로 우유통을 이용한 발사체에 사용되기도 한다.[22]
인화 칼슘과 함께 홀름스 해양 생물 보호 협회에서 생산하는 자체 발화하는 부표식 해상 신호탄에도 사용된다.
토양 수분 함량을 측정하는 데에도 사용된다. 밀폐된 용기에서 토양과 탄화 칼슘을 혼합하면 발생하는 아세틸렌 압력을 측정하여 수분 함량을 알 수 있다.[23][24]
시판되는 두더지 퇴치제로도 사용된다.[25] 물과 접촉하면 발생하는 가스가 두더지를 쫓아낸다.[26]
네덜란드와 벨기에에서는 금속제 원통에 탄화칼슘과 물을 넣고 발생한 가스에 점화하여 큰 소리를 내는 "Carbidschieten"(카바이드 쏘기)라는 전통 놀이가 있다.
참조
[1]
논문
The many phases of CaC2
Elsevier BV
[2]
웹사이트
NFPA Hazard Rating Information for Common Chemicals
https://web.archive.[...]
[3]
서적
Handbook of Inorganic Chemical Compounds
https://books.google[...]
McGraw-Hill
[4]
서적
Risk Management for Hazardous Chemicals
https://books.google[...]
CRC Press
1996-11-25
[5]
서적
CRC Handbook of Chemistry and Physics
[6]
서적
Ullmann's Encyclopedia of Industrial Chemistry
2013
[7]
논문
Manufacture of Cyanamide
https://books.google[...]
[8]
논문
The Manufacture of Calcium Carbide
https://zenodo.org/r[...]
[9]
논문
Chimie Minérale – Description d'un nouveau four électrique
http://gallica.bnf.f[...]
[10]
논문
The use of Acetylene
https://books.google[...]
[11]
웹사이트
Zgrada Prve hidrocentrale na Balkanu - Komisija za očuvanje nacionalnih spomenika
http://old.kons.gov.[...]
KONS
2019-03-15
[12]
웹사이트
Troubles in the PVC industry
http://www.tdctrade.[...]
Hong Kong Trade Development Council
2006-01-23
[13]
뉴스
Government takes measures to curb development of calcium carbide sector
http://www.busytrade[...]
China Daily via BusyTrade.com
2007-05-16
[14]
웹사이트
Calcium Carbide
http://www.sriconsul[...]
SRI Consulting
2004-12
[15]
redirect
[16]
서적
Greenwood&Earnshaw2nd
[17]
웹사이트
Caving equipment and culture (from Te Ara Encyclopedia of New Zealand)
http://www.teara.gov[...]
[18]
서적
American Miners' Carbide Lamps: A Collectors Guide to American Carbide Mine Lighting
Westernlore Publications
[19]
논문
Abscission: The Role of Ethylene, Ethylene Analogues, Carbon Dioxide, and Oxygen
[20]
뉴스
Bet on it. Your mango is ripened using carbide
http://www.dnaindia.[...]
2013-05-18
[21]
웹사이트
Eating Artificially Ripened Fruits is Harmful
https://www.research[...]
[22]
웹사이트
Carbidschieten wordt feest
http://www.ad.nl/dos[...]
Algemeen Dagblad
2016-12-24
[23]
웹사이트
Determining Water Content In Soil – Calcium Carbide Method
https://www.engineer[...]
2008-12-17
[24]
웹사이트
ASTM D4944-18, Standard Test Method for Field Determination of Water (Moisture) Content of Soil by the Calcium Carbide Gas Pressure Tester
https://www.astm.org[...]
ASTM International
[25]
웹사이트
Molehill Mayhem
https://dspace.libra[...]
2014-02-20
[26]
웹사이트
How to Get Rid of Yard Moles With Carbide
http://www.mysunnyla[...]
[27]
논문
[28]
간행물
三居沢発電所考
[29]
논문
Structure and Properties of Mechanically Activated Barium Peroxide
[30]
웹사이트
NFPA Hazard Rating Information for Common Chemicals
https://web.archive.[...]
[31]
서적
Handbook of Inorganic Chemical Compounds
https://books.google[...]
McGraw-Hill
[32]
서적
Risk Management for Hazardous Chemicals
https://books.google[...]
CRC Press
1996-11-25
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com